
Estudio realizado en colaboración con
la Universidad de Modena y Reggio Emilia
LEVADURAS PARA VINOS ESPUMOSOSESTRATEGIAS DE EVOLUCIÓN ADAPTATIVA Y DE BREEDING PARA LA SELECCIÓN DE STARTERS OPTIMIZADOS
Los vinos espumosos ocupan una posición muy importante en el sector vitivinícola y su creciente popularidad entre los consumidores, cada vez más atentos a la calidad del producto, fomenta también la investigación hacia la selección de starter optimizados para el proceso de elaboración de espumosos.
Para superar estos problemas y elaborar un buen vino espumoso, es necesario conocer bien los mecanismos de la fermentación y prestar mucha atención a todas las etapas de la elaboración, desde la vinificación de la uva hasta la elección del método de elaboración del vino espumoso, pero sobre todo es necesario elegir una cepa starter.
El uso de levaduras inadecuadas puede comprometer el producto final, ralentizando o bloqueando de forma anómala el proceso.
Además, la falta de oxígeno impide la síntesis de esteroles y de ácidos grasos insaturados, alterando la funcionalidad de la membrana celular de las levaduras.
La evidencia científica confirma los efectos indeseables sobre las levaduras, en términos de reducción de la actividad y del vigor fermentativo, debido a la acumulación de CO2 durante el proceso.
Los ácidos orgánicos débiles y su influencia en el metabolismo celular
Para comprender mejor estos efectos, es necesario tener en cuenta la acción de los ácidos orgánicos débiles, que influyen en el metabolismo de la célula de forma similar a como lo hace el dióxido de carbono.
El CO2, de hecho, aunque en bajas concentraciones, forma ácido carbónico, que es un ácido débil. Si evaluamos las constantes de disociación ácida del ácido carbónico y otros ácidos orgánicos débiles, se puede observar que tienen valores aproximadamente similares, por lo que el estado disociativo de estas moléculas en las matrices intra y extracelulares será razonablemente similar.
Los ácidos orgánicos débiles con un valor de pH de alrededor de 3-3,5, se encuentran en la forma no disociada XCOOH, en este estado pueden entrar libremente a la célula donde el pH es de 7,4.
A este valor, los iones XCOOH- y H+ se disocian en el anión carboxílico. Los aniones carboxilo no pueden salir pasivamente de la membrana y se acumulan dentro del citoplasma. Esta acumulación induce diversas respuestas celulares al estrés y si no se controla, también puede inducir la apoptosis.
La nueva cepa de levadura obtenida mediante mejora interespecífica
El enfoque evolutivo también se puede aplicar en programas de mejora para obtener híbridos tanto intra como interespecíficos. En un primer trabajo realizado por el grupo de investigación de la Unimore Microbial Culture Collection (UMCC), el enfoque evolutivo, anteriormente descrito, ha permitido obtener una nueva cepa de Saccharomyces cerevisiae, depositada con el código UMCC 2949, con las características fenotípicas de interés, como resistencia a ácidos orgánicos débiles.
Con el fin de validar la hipótesis experimental de correspondencia con la resistencia a altas concentraciones de CO2, se realizaron pruebas de espumatización en prototipos de autoclave, en los que la cepa seleccionada ha funcionado.
Para mejorar posteriormente la cepa UMCC 2949 confiriéndole también una mayor resistencia a las bajas temperaturas se ha aplicado posteriormente una estrategia de breeding interespecífica, cruzando la cepa de S. cerevisiae con la cepa UMCC 2633 de la especie S. uvarum. Las colonias resultantes de los diferentes cruces entre las esporas de las dos cepas parentales se caracterizaron a nivel molecular, mediante análisis "colony PCr" y RFLP (Restriction Fragment Length Polymorphism) de la región ITs-5.8s del rNA, con el fin de confirmar la formación de híbridos (ver a continuación Figura 1).
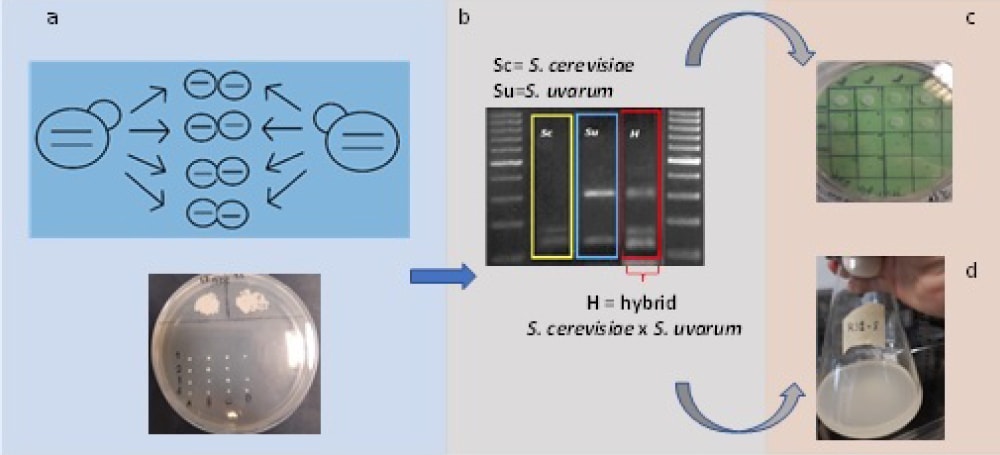
Figura 1
Representación esquemática de la estrategia de breeding específico:
a) cruce espora-espora directo entre la cepa S. cerevisiae y S. uvarum;
b) caracterización molecular de los cultivos derivados de los cruces;
c) tamizaje fenotípico;
d) pruebas de fermentación para evaluar el comportamiento del híbrido.
El rendimiento de fermentación de la nueva levadura
Posteriormente, el híbrido seleccionado, denominado UMCC 3008, ha sido testado en medios selectivos para verificar la tolerancia al etanol de 12% y 15%, en dos diversas condiciones de temperatura, respectivamente 15 y 27°C, y la resistencia al ácido acético en concentraciones de 50 mM y 75 mM. El comportamiento fermentativo del híbrido UMCC 3008 se evaluó preliminarmente en pruebas de microvinificación realizadas en matraces con vino base adicionado con sacarosa a la concentración final de 30g/L. Finalmente, se realizó una prueba en medio de crecimiento BIGGY agar para una estimación cualitativa de la producción de sulfuro de hidrógeno.
RESULTADOS DE LA INVESTIGACIÓN
Los exámenes fenotípicos han evidenciado los siguientes resultados para el nuevo hibrido UMCC 3008 y de la cepa UMCC2949 (ver la tabla 1 inferior):
- tolerancia al etanol en las condiciones probadas;
- resistencia a concentraciones de ácido acético hasta 50 mM;
- baja producción de H2S;
- buena tolerancia a las presiones selectivas aplicadas en el cribado fenotípico;
- excelente aptitud fermentativa en pruebas de microvinificación.
Por lo tanto, se cree que este híbrido y su ancestro son excelentes candidatos como cultivos starter para ser validados mediante posteriores experimentos con el fin de confirmar su desempeño fermentativo y su aptitud para la producción de vinos espumosos.
| Código UMCC | Especies | Etanol 12% |
Etanol 15% |
Ácido acético 50 mM |
Ácido acético 75 mM |
H2S (Biggy agar) |
||
|---|---|---|---|---|---|---|---|---|
| 15° | 27° | 15° | 27° | 27° | 27° | 27° | ||
| UMCC 2949 | S. cerevisiae | + | + | + | + | + | + | promedio |
| UMCC 2633 | S. uvarum | + | + | - | - | + | - | bajo |
| UMCC 3008 | S. cerevisiae x S. uvarum | + | + | + | + | + | - | bajo |
Tabla 1
Cribado de resistencia al etanol, realizado en medio YPDA adicionado con etanol al 12% o al 15% (incubación a 15°C y 27°C) y al ácido acético, realizado en medio mínimo Yeast Nitrogen Base (YNB) con ácido acético adicionado 50 mM o 75mM, además, VALORACIÓN cualitativa de la producción de H2S en medio BIGGY agar, después de 6 días de incubación de las placas.


 United Kingdom
United Kingdom




